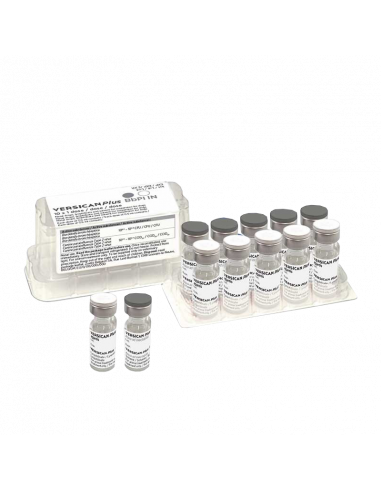
VERSICAN PLUS BbPi IN 5 Dosis
1. DENOMINACIÓN DEL MEDICAMENTO VETERINARIO
Versican Plus BbPi IN liofilizado y disolvente para gotas nasales en suspensión para perros
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada dosis de 0,5 ml contiene:
Sustancias activas:
Bordetella bronchiseptica viva atenuada, cepa MSLB 3096 108,0 – 109,8 UFC*
Virus de parainfluenza canina, viva atenuada, tipo 2, cepa CPiV-2 Bio 15 103,5 – 105,8 DICC50**
* UFC: Unidad formadora de colonias
** DICC50: Dosis infectiva en cultivo celular 50%
Excipientes:
Disolvente: Agua para preparaciones inyectables 0,5 ml
Para la lista completa de excipientes, véase la sección 6.1.
3. FORMA FARMACÉUTICA
Liofilizado y disolvente para gotas nasales en suspensión para perros. Liofilizado: esponjoso, de color blanquecino a amarillento. Disolvente: líquido claro incoloro.
4. DATOS CLÍNICOS
4.1 Especies de destino
Perros.
4.2 Indicaciones de uso, especificando las especies de destino
Para la inmunización activa de perros a partir de 3 semanas de edad:
− para reducir los signos clínicos y excreción bacteriana después de la infección con Bordetella bronchiseptica y
− para reducir signos clínicos y excreción viral después de la infección con el virus de la parainfluenza canina.
Establecimiento de la inmunidad: 3 días después de la primera vacunación para Bordetella bronchiseptica.
7 días después de la primera vacunación para el virus de la parainfluenza canina.
Duración de la inmunidad: 1 año.
4.3 Contraindicaciones
Ninguna.
4.4 Advertencias especiales para cada especie de destino
Vacunar únicamente animales sanos.
Este medicamento veterinario contiene una cepa bacteriana viva atenuada por lo que los antibióticos pueden interferir con la eficacia de la vacuna. Por lo tanto, los animales vacunados no deben recibir tratamiento antibiótico. Si se usan antibióticos en el plazo de una semana después de la vacunación, se debe repetir la vacunación frente a Bordetella bronchiseptica, es decir, con una vacuna monovalente Bb (si se encuentra disponible) después de completar el tratamiento antibiótico.
4.5 Precauciones especiales de uso
Precauciones especiales para su uso en animales
Después de la vacunación, los perros pueden excretar la cepa vacunal de Bordetella bronchiseptica hasta 11 semanas y la cepa vacunal del virus de la parainfluenza canina durante 8 días. Los perros no vacunados en contacto con perros vacunados pueden manifestar signos clínicos leves como estornudos y secreciones nasales y oculares.
No se pudo demostrar la transmisión de las cepas vacunales a gatos, cerdos y roedores. No obstante, al no poder rechazarse la posibilidad de transmisión a otras especies diferentes a la de destino, se recomienda mantener a los animales no vacunados fuera del contacto directo con los perros vacunados durante al menos 4 semanas.
El manejo seguro, la adecuada administración de la vacuna y la eliminación del material usado contribuyen a eliminar el riesgo de diseminación de los antígenos vacunales en el lugar de trabajo veterinario.
Precauciones específicas que debe tomar la persona que administre el medicamento veterinario a los animales
Las manos y herramientas deben ser desinfectadas después de su uso. En caso de autoadministración accidental durante la dilución del medicamento veterinario o inhalación del mismo en forma de aerosol durante la administración en el orificio nasal del perro, consulte con un médico inmediatamente y muéstrele el prospecto o la etiqueta. Aunque el riesgo de que las personas inmunodeprimidas puedan infectarse con Bordetella bronchiseptica sea extremadamente bajo, debe tenerse en cuenta que los perros pueden excretar la bacteria durante varias semanas después de la vacunación. Se recomienda a las personas inmunodeprimidas que eviten el contacto con la vacuna y con los perros vacunados durante la excreción.
4.6 Reacciones adversas (frecuencia y gravedad)
Se observa secreción nasal leve transitoria muy frecuentemente, secreción ocular leve y depresión leve frecuentemente y estornudos leves infrecuentemente en animales tras la vacunación.
Estos signos generalmente desaparecen sin tratamiento en el plazo de uno a tres días. Se observó una tos de leve a moderada frecuentemente en perros vacunados de la perrera a partir de los nueve días tras la vacunación cuando se alojaron junto con perros no vacunados.
La frecuencia de las reacciones adversas se debe clasificar conforme a los siguientes grupos:
− Muy frecuentemente (más de 1 animal por cada 10 animales tratados presenta reacciones adversas)
− Frecuentemente (más de 1 pero menos de 10 animales por cada 100 animales tratados)
− Infrecuentemente (más de 1 pero menos de 10 animales por cada 1.000 animales tratados)
− En raras ocasiones (más de 1 pero menos de 10 animales por cada 10.000 animales tratados)
− En muy raras ocasiones (menos de 1 animal por cada 10.000 animales tratados, incluyendo casos aislados).
4.7 Uso durante la gestación, la lactancia o la puesta
No ha quedado demostrada la seguridad del medicamento veterinario durante la gestación y la lactancia. Por tanto, su uso no está recomendado durante la gestación y la lactancia.
4.8 Interacción con otros medicamentos y otras formas de interacción
Se ha demostrado que este medicamento veterinario es seguro en perros a partir de las 8 semanas de edad cuando se administra al mismo tiempo que las vacunas de la gama Versican Plus y Vanguard que contienen los virus vivos del parvovirus canino, adenovirus, virus del moquillo y virus de la parainfluenza así como formas inactivadas de Leptospira y del virus de la rabia. Se observaron muy frecuentemente leves (< 1 ºC) aumentos transitorios de temperatura después de la co-administración de estas vacunas.
La eficacia después del uso concurrente no se ha probado. Por lo tanto, si bien se ha demostrado la seguridad del uso simultáneo, el veterinario debe tenerlo en cuenta cuando decida administrar los medicamentos al mismo tiempo.
Aunque se ha demostrado su seguridad, no debería ser necesario administrar una vacuna de parainfluenza dos veces por dos vías diferentes, por lo que el veterinario debería considerar las opciones de vacunación basadas en la disponibilidad local de vacunas básicas sin parainfluenza y vacunas monovalentes frente a Bordetella.
No existe información disponible sobre la seguridad y la eficacia del uso de esta vacuna con cualquier otro medicamento veterinario excepto los medicamentos mencionados anteriormente. La decisión sobre el uso de esta vacuna antes o después de la administración de cualquier otro medicamento veterinario se deberá realizar caso por caso.
4.9 Posología y vía de administración
Vía nasal.
Dosis y vía de administración:
Reconstituir asepticamente el liofilizado con el disolvente. Agitar bien después de la reconstitución. Retirar el líquido con la jeringa, eliminar la aguja y administrarlo directamente desde la punta de la jeringa dentro de un orificio nasal. Como alternativa, se puede conectar un aplicador intranasal (disponible por separado) a la jeringa y administrar después la dosis en un orificio nasal. La vacuna debe utilizarse inmediatamente.
La cabeza del perro debe sostenerse con la nariz apuntando hacia arriba. Administrar una dosis (0,5 ml) de la vacuna reconstituida en un orificio nasal.
Vacuna reconstituida: de color blanquecino a amarillento con una ligera opalescencia.
Primovacunación:
Una única dosis a partir de las 3 semanas de edad
Revacunación:
Administrar una única dosis anualmente
4.10 Sobredosificación (síntomas, medidas de urgencia, antídotos), en caso necesario
No se han observado reacciones adversas aparte de las mencionadas en la sección 4.6 tras la administración de una sobredosis de 10 veces la dosis vacunal.
4.11 Tiempo(s) de espera
No procede.
5. PROPIEDADES INMUNOLÓGICAS
Grupo farmacoterapéutico: Inmunológicos para cánidos, vacuna bacteriana viva y vírica viva. Código ATC vet: QI07AF01.
6. DATOS FARMACÉUTICOS
6.1 Lista de excipientes
Liofilizado:
Glucosa
Sacarosa
Dextran 40
Cloruro de sodio
Cloruro de potasio
Hidrógenofosfato de disodio dodecahidrato
Dihidrógenofosfato de potasio
Disolvente: Agua para preparaciones inyectables
6.2 Incompatibilidades principales
No mezclar con ningún otro medicamento veterinario, excepto el diluyente suministrado para su uso con el medicamento veterinario.
6.3 Período de validez
Período de validez del medicamento veterinario acondicionado para su venta: 2 años.
Período de validez después de su reconstitución según las instrucciones: uso inmediato.
6.4. Precauciones especiales de conservación
Conservar y transportar refrigerado (entre 2 ºC y 8 ºC).
No congelar.
Proteger de la luz.
6.5 Naturaleza y composición del envase primario
Vial de cristal Tipo I conteniendo 1 dosis de liofilizado cerrado con un tapón de goma de bromobutilo sellado con cápsula de aluminio. Vial de cristal Tipo I conteniendo 0,5 ml de disolvente cerrado con un tapón de goma de clorobutilo y sellado con una cápsula de aluminio.
Formatos:
Caja de plástico transparente con 5 viales de liofilizado (1 dosis) y 5 viales de disolvente (0,5 ml).
Caja de plástico transparente con 10 viales de liofilizado (1 dosis) y 10 viales de disolvente (0,5 ml).
Es posible que no se comercialicen todos los formatos.
Los aplicadores se envasan por separado y pueden distribuirse junto con la vacuna si se solicita.
6.6 Precauciones especiales para la eliminación del medicamento veterinario no utilizado o, en su caso, los residuos derivados de su uso
Todo medicamento veterinario no utilizado o los residuos derivados del mismo deberán eliminarse de conformidad con las normativas locales.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Zoetis Spain, S.L.
Parque Empresarial Vía Norte
Edificio nº 1
c/ Quintanavides nº 13
28050 Madrid
España
8. NÚMERO(S) DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
3878 ESP
9. FECHA DE LA PRIMERA AUTORIZACIÓN/RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 03/2020
10. FECHA DE LA REVISIÓN DEL TEXTO
Mayo 2020
PROHIBICIÓN DE VENTA, DISPENSACIÓN Y/O USO
No procede.
Uso veterinario
Condiciones de dispensación: Medicamento sujeto a prescripción veterinaria.
Condiciones de administración: Administración bajo control o supervisión del veterinario
- Prescripción Médica
- SI
- Producto en frío
- Sí
- Principios activos
- BORDETELLA BRONCHISEPTICA VIVA
VIRUS DE LA PARAINFLUENZA CANINA VIVO ATENUADO/ TIPO 2/ CEPA CPIV-2-BIO 15
Te puede interesar